|
★ ★ ☆
<<< Precedente -
Successivo >>>
CONTENUTO DELLA PAGINA
Primo principio della termodinamica
Applicazioni del primo principio
Primo principio della termodinamica
Il primo principio ha lo scopo estendere il principio di conservazione dell'energia meccanica a qualunqua altra forma (chimica, termica, elettrica…) in ogni sistema e con qualunque trasformazione fisica si utilizzi; utilizzando l'energia interna appena descritta, possiamo affermare che:
|
Ⅰ principio della termodinamica.
Ogni corpo possiede una energia interna U, la cui variazione dipende dagli scambi di calore e dal lavoro che coinvolgono tale corpo.
|
In cui per convenzione si assume che:
- il calore che il corpo riceve dall'esterno è considerato positivo;
- il calore che il corpo cede all'esteno è considerato negativo;
- il lavoro compiuto dal corpo verso l'esterno è considerato positivo;
- il lavoro compiuto dall'esterno verso il corpo è considerato negativo.
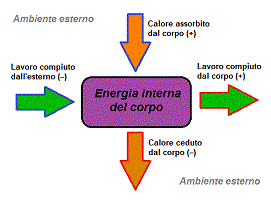 Figura 1
Figura 1
Di conseguenza, con riferimento alla figura 1:
- l'energia interna aumenta quando il corpo riceve calore dall'esterno o quando dall'esterno si compie lavoro sul corpo (frecce con il bordo blu);
- l'energia interna diminuisce quando il corpo cede calore all'esteno o quando il corpo compie lavoro verso l'esterno (frecce con il bordo rosso).
Osservazione: in una trasformazione ciclica, si torna allo stato iniziale, di conseguenza l'energia interna torna ad esser quella che c'era all'inizio: quindi ΔU = 0.
|
Esempio 3. Un gas assorbe dall'esterno 120J di calore, e per questo si espande, compiendo un lavoro di 80J; di quanto varia la sua energia interna?
Dati.
Calore (ricevuto): Q = +120J
Lavoro (compiuto dal gas): Q = +80J
Variazione di energia: ΔU = incognita
Soluzione:
In base alla formula e all'impostazione dei segni, la variazione di energia interna è:
ΔU = Q − L = (+120J) − (+80J) = 40J
Conclusione: l'energia interna del gas è aumentata di 40J.
|
Nel piano pV il lavoro compiuto da una trasformazione corrisponde all'area (integrale) compresa tra la linea e l'asse orizzontale: ad esempio nel caso di una trasformazione isobara corrisponde all'area di un rettangolo, mentre in una trasformazione isocora l'area è nulla ed infatti il lavoro è zero.
In una trasformazione ciclica il lavoro corrisponde all'area racchiusa all'interno della linea chiusa.
^
Torna su
Applicazioni del primo principio
Da questo principio possiamo quindi generalizzare il principio di conservazione dell'energia:
|
L'energia presente nell'universo non si crea né si distrugge, ma si trasforma da una forma ad un'altra, per mezzo di lavoro o di scambi di calore.
|
Vediamo come si declina questo principio nelle varie trasformazioni viste in base anche alle leggi della calorimetria.
In particolare ricordiamo che il calore specifico molare può esser:
- a pressione costante il calore molare cp vale:
cp = 5R ⁄ 2 nei gas monoatomici;
cp = 7R ⁄ 2 nei gas biatomici;
- a volume costante il calore molare cv vale:
cv = 3R ⁄ 2 nei gas monoatomici;
cv = 5R ⁄ 2 nei gas biatomici.
E quindi in generale: cp − cv = R.
♦ Trasformazioni isobare ♦
Nelle trasformazioni isobara la pressione rimane costante, quindi il lavoro compiuto si può calcolare semplicemente come prodotto tra pressione e variazione di volume.
♦ Trasformazioni isocore ♦
Nelle trasformazioni isocore il volume non varia, quindi non c'è spostamento: per questo motivo il lavoro è zero. Dal primo principio si ottiene:
♦ Trasformazioni isoterme ♦
Nelle trasformazioni isoterma la temperatura non varia, di conseguenza non varia neanche l'energia interna: per questo motivo dal primo principio si ricava quindi che il lavoro compiuto equivale al calore scambiato. Tale quantità vale di preciso:
♦ Trasformazioni adiabatiche ♦
La trasformazione adiabatica è una particolare trasformazione in cui, pur variando tutte e tre le grandezze, non avvengono scambi di calore con l'esterno: Q = 0.
Il primo principio diventa quindi:
|
Esempio 4. Un gas monoatomico che occupa un volume iniziale di 1m³ si trova ad una temperatura di 300K, pressione 15kPa; esso subisce prima una trasformazione isocora fino ad una temperatura di 340K, quindi una isoterma fino ad un volume di 5m³; quanto varia la sua energia interna?
Dati.
Stato iniziale:
𝒱0 = 1m³; T0 = 300K; p0 = 15kPa
Stato intermedio:
𝒱1 = 𝒱0; T1 = 340K
Stato finale:
𝒱2 = 5m³; T2 = T1
ΔU = incognita.
Soluzione:
Dalle condizioni inziali si può ricavare il numero di moli, applicando la legge di stato:
n = p0 𝒱0 ⁄ R T
n = ((15 · 10³ · 1) ∶ (8,31 · 300))mol
n ≈ 6mol
La prima trasformazione è isocora, percui:
ΔU1 = n cv ΔT
ΔU1 = (6 · 3/2 · 8,31 · 40)J
ΔU1 ≈ 2,99 · 10³J
La seconda trasformazione invece è isoterma, percui:
ΔU2 = 0J
Conclusione: l'energia interna del gas aumenta in totale di circa 3kJ.
|
^
Torna su
<<< Precedente -
Successivo >>>
|
