| Inizio | News | CALORIMETRIA | Info |
|
|
<<< Precedente - Successivo >>> Passaggi di stato Lo stato di aggregazione di una sostanza, o fase, è una caratteristica che coinvolge la natura fisica di una sostanza e dipende dalla sua temperatura e pressione: per una introduzione agli stati di aggregazione della materia, visita questa pagina. Un I passaggi di stato prendono il nome a seconda di quali stati coinvolgono (vedi figura 1):
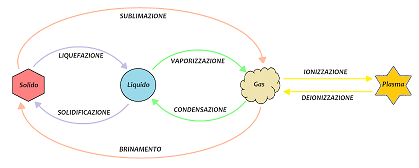
Per ottenere lo stato di fluido supercritico, occore aumentare le temperatura e la pressione al di sopra dei valori di punto critico. In generale, a pressione fissata, per passare da stato solido a liquido, da solido a gas, da liquido a gas o da gas a plasma occorre fornire calore alla sostanza; al contrario per operare le trasformazioni inverse occore togliere calore alla sostanza, o meglio, la sostanza deve cedere calore all'ambiente. Calore latente Fornendo calore ad un corpo allo stato solido la temperatura aumenta fino al raggiungimento di una particolare temperatura alla quale il corpo passa dallo stato solido al liquido; analogamente fornendo calore ad un corpo allo stato liquido la temperatura aumenta fino al raggiungimento di un'altra particolare temperatura alla quale si ha il passaggio da liquido a gas. La temperatura alla quale avviene il passaggio da solido a liquido (o viceversa) si chiama 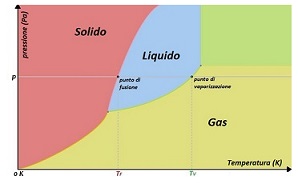
Abbiamo visto la pagina precedente come il calore faccia aumentare la temperatura del corpo, in base alla legge della calorimetria; tuttavia questo non avviene durante il passaggio di stato.
Il calore necessario per far passare completamente di stato un corpo si calcola con la formula:
Dove m è la massa del corpo e λ(x) è un coefficiente chiamato
Attenzione a non confondere il calore latente con il coefficiente di dilatazione lineare!
Calore e passaggi di stato Sintetizziamo quanto abbiamo visto: fornendo calore ad un corpo allo stato solido, esso aumenterà la temperatura fino a raggiungere la temperatura di funzione (TF); continuando a fornire calore, la temperatura si stabilizza e il corpo inizia a passare allo stato liquido; una volta che tutto il corpo è allo stato liquido, il calore fornito riprende a far aumentare la temperatura, fino al raggiungimento della temperatura di vaporizzazione (TV); anche in questo caso, continuando a fornire calore, la temperatura si ristabilizza e il corpo inizia a passare allo stato gassoso; quando tutto il corpo è allo stato gassoso, il calore fornito riprende a far aumentare la temperatura. 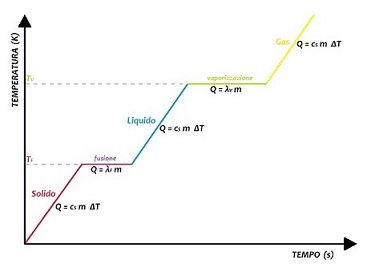
Nel grafico si descrive la variazione di temperatura in funzione del tempo trascorso, in una situazione in cui il calore viene fornito con potenza costante e a pressione costante; le due zone pianeggianti corrispondono ai due passaggi di stato, in cui la temperatura non varia nel tempo; le zone inclinate indicano la invece l'aumento di temperatura nel tempo, dovuto alla presenza di un solo stato (solido, liquido o gas). <<< Precedente - Successivo >>> |
| Condizioni di utilizzo | Contatti | Created by Stefano Caroselli | Mappa |