|
★ ☆ ☆
<<< Precedente -
Successivo >>>
CONTENUTO DELLA PAGINA
Stati di aggregazione della materia
Il punto triplo
Il punto critico
Stati di aggregazione della materia
Con il termine stato di aggregazione della materia , o fase , si intende la condizione fisica di un corpo in relazione alle proprietà meccaniche che possiede, in particolare alla propria forma e alla propria dimensione.
Gli stati di aggregazione conosciuti in natura sono quattro:
Solido , in cui un corpo possiede una forma e una dimensione proprie: in assenza di forze esterne, un solido tende a conservare la sua forma e il suo volume; un solido è quindi incomprimibile e indeformabile; le molecole sono strettamente legate tra loro e non possono muoversi.
Liquido , in cui un corpo possiede una dimensione propria, ma la forma si adatta a quella del recipiente che lo contiene; un liquido è incomprimibile, ma si può deformare; le molecole possono muoversi ma non possono allontanarsi tra loro.
Gas o Aeriforme , in cui un corpo non possiede forma e dimensione proprie, ma entrambe si adattano a quella del recipiente che lo contiene: un gas si può espandere, comprimere o deformare per riempire tutto lo spazio interno al recipiente; le molecole possono muoversi liberamente e allontanarsi tra loro.
Plasma , in cui un corpo non possiede forma e dimensione proprie, ma entrambe si adattano a quella del recipiente che lo contiene: un plasma si comporta quindi come un gas, ma non possiede molecole (o ne possiede in piccola parte), bensì ioni, ossia atomi con troppi elettroni (o troppo pochi) che si muovono liberamente tra loro.
Ogni elemento e ogni sostanza può trovarsi in uno di questi quattro stati, a seconda delle proprie condizioni di pressione e temperatura; per arrivare al quarto stato, il plasma, è necessario che la sostanza aumenti notevolmente la temperatura, in modo da esser ionizzata, così da subire un'alterazione molecolare.
Possiamo rappresentare in un piano cartesiano con pressione e temperatura un grafico che descriva gli stati che può assumere una sostanza (ad eccezione dello stato di plasma) al variare delle proprie condizioni; tale grafico è chiamato diagramma di fase .
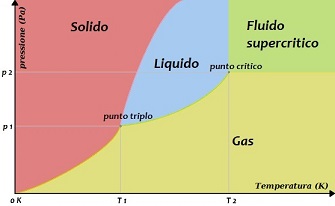 Figura 1
Figura 1
Variando pressione o temperatura si può verificare un passaggio di stato: una trasformazione fisica che permette di passare da uno stato ad un altro stato limitrofo.
La caratteristica fondamentale che si osserva nel diagramma è che all'aumentare della temperatura (e al diminuire della pressione) un corpo passa da solido a liquido e poi da liquido a gas.
^
Torna su
Il punto triplo
Per ogni sostanza esiste una condizione particolare di temperatura e pressione, in cui possono coesistere contemporaneamente i tre stati: tale condizione si definisce punto triplo ; per particolari temperature o pressioni molto basse, al di sotto dei valori del punto triplo, non è possibile ottenere lo stato liquido, ma si passa direttamente dallo stato solido a quello gassoso.
Ecco degli esempi di valori di temperatura (T1) e pressione (p1) dei punti tripli di alcune sostanze inoltre .
| SOSTANZA | T1 (K) | p1 (Pa) |
|---|
| Idrogeno | 13,84 | 7040 |
| Ossigeno | 54,36 | 152 |
| Azoto | 63,18 | 12600 |
| An. carbonica | 216,55 | 5,17·105 |
| Mercurio | 234 | 1,65·10−4 |
| Acqua | 273,16 | 611,7 |
| Platino | 2045 | 0,2 |
| Carbonio | 4765 | 1,01·107 |
^
Torna su
Il punto critico
Un'altra condizione molto particolare è quella di punto critico : per valori di temperatura e pressione al di sopra di tale punto non esiste più una netta differenza tra stato liquido e gas, ma si ha una situazione si fluido intermedio, chiamato fluido supercritico .
Si ipotizza l'esistenza di altri stati di aggregazione, ma al momento in natura non sono ancora noti.
Il diagramma di fase è molto simile in ogni sostanza: la principale differenza sono i valori di temperatura e pressione che identificano i due punti particolari (punto triplo e punto critico), in quanto ogni sostanza ha valori propri.
L'acqua fa eccezione, in quanto il suo grafico è leggermente differente: la linea che separa lo stato solido da quello liquido ha un'inclinazione opposta, salendo tende ad andare verso sinistra.
Per approfondire sui passaggi di stato, visita questa pagina, nella sezione di Calorimetria.
^
Torna su
<<< Precedente -
Successivo >>>
|
